NOTICIAS FRESCAS: ACABA DE PUBLICARSE UN ESTUDIO HORMONAL con ratones donde se han tenido en cuenta las variables agresividad, apetito sexual, testosterona… y la gran protagonista del artículo: la molécula/proteína TRPM8 (pronúnciese en inglés trip-M-eight). No, no tiene relación con sustancias alucinógenas ni psicotrópicas (Lucy Sigue en el cielo con sus Diamantes). Lo interesante es que esta molécula puede contener y «saciar» tanto la agresividad como la libido; por ahora en ratones, pero es algo probable que se aplique en humanos en un futuro. ¿Te imaginas, entre otras aplicaciones, que al fin se halle el «elixir» que favorezca la rehabilitación de muchos miembros de la población penitenciaria, mayoritariamente masculina? ¿Hasta qué punto sería eficaz?
Esta entrada se basa en el estudio de Eleonora Zakharian y colaboradores (Nersesyan et al. 2019), de la University of Illinois College of Medicine. Se presentó el pasado 2 de marzo en el 63.º congreso anual de la Biophysical Society, en Baltimore (ciudad entre Washington DC y Nueva York, Maryland, EE. UU).
Hablemos de testosterona
Es todo un tópico de la psicología popular, difundido por los medios de comunicación, el relacionar las hormonas andrógenas como la testosterona (T) como principal causante de la agresividad ─en los varones, sobre todo, al tener más T que las mujeres─ y del deseo sexual. Pero la realidad es más compleja y esto debe ser matizado.
En primer lugar, lo que parece estar más acorde con la realidad es que existe una correlación (si una variable aumenta, la otra también; sin ser ninguna causante de la otra) entre la T y la agresividad, observada, sobre todo, en estudios con ratones (véanse Conner y Levine, 1969 [en roedores]; Sánchez-Martín, 2000 [en niños]).
En concreto, y simplificándolo mucho, en ratas se ha observado que los niveles de T previos al nacimiento son responsables de ser organizadores cerebrales ante la respuesta de andrógenos, y que, luego, durante la pubertad, estos niveles vuelven aumentar con la correspondiente manifestación de agresividad en dichos animales.
Lo curioso es que se procedió a castrar a esas ratas en dos grupos: unas, justo al nacer; las otras, un tiempo después. Se observó que la T inyectada tras la castración tenía un efecto activador en aquellos roedores que fueron castrados posteriormente, por lo que se concluyó que la T debe actuar primero como organizadora de las estructuras neuronales durante los primeros meses de vida, y que son receptoras de esta hormona para que esta influya en la conducta agresiva (Conner y Levine).
En humanos, los resultados son menos concluyentes. Las investigaciones más recientes apuntan también a una correlación. Se habla de una relación bidireccional entre la T y la agresión: un determinado nivel hormonal puede repercutir en la agresión y, por el contrario, el aumento de la agresividad puede influir en los niveles hormonales (Archer, 2006). Incluso el contexto sociocultural (donde te crías, trabajas, tu educación, relaciones sociales, etc.) puede llevar a cambios endocrinos también que, a su vez, influyen en la agresión; esto se debe a la interacción agresiva (Andreu, García-Bonacho, Esquifino y Ramírez, 2001).
Papel de algunos neurotransmisores en la conducta agresiva
Pero, como sabemos, los fenómenos biológicos no tienen una sola causa, y que también influyen otros factores en la conducta agresiva, entre ellos, los niveles de los neurotransmisores serotonina (SE) y de dopamina (DA). En estudios con ratones se ha visto que aquellos cuyos receptores 5-HT1A no se estimulaban o que la actividad de las neuronas serotoninérgicas era muy reducida, la conducta agresiva aumentaba; y que, en cambio, estimular dichos receptores hace que la dicha conducta se reduzca (Kavoussi, Armstead y Coccaro, 1997). En cuanto a la DA, si su actividad aumenta en el cerebro (y hay poca SE que reduzca la actividad de la DA), entonces la agresión aumenta (véase Mann, 1994).
Volviendo al tema que nos ocupa en esta entrada (Biophysical Society, 1 de marzo de 2019), esta molécula (proteína/gen) se asocia a un sensor de bajas temperaturas del cuerpo. Por otra parte, hace unos años, la investigadora Zakharian se preguntó qué relación tenía con la próstata. Estas investigaciones desembocaron en utilizar esta proteína en terapia génica para tratar el cáncer de próstata debido a su relación con la regulación de los andrógenos y los canales de calcio en las células de esa región (véase Zhang y Barritt, 2004). Entonces publicó que se trata en realidad de un receptor de los niveles de T, lo que nos lleva a comprobar qué sucedería a los ratones faltos de esta molécula (TRPM8−/−) (knockout).
Los machos sin este gen se comportaron de forma violenta y muy sexual al mostrar más conductas de monta durante mucho más tiempo que los ratones del grupo control. Por otra parte, las hembras también manifestaron una conducta más lujuriosa al mostrarse más receptivas a ser montadas y al aumentar su conducta olfatoria ─olisqueando mucho más que las hembras control─, señal del incremento del apetito sexual. Sin embargo, estos hechos no fueron fáciles de comprobar en las hembras debido a la conducta sexual desorbitada de los roedores machos.
Por consiguiente, Zakharian concluyó que el gen TRPM8 forma parte del mecanismo activado por la testosterona que comunica la sensación de satisfacción sexual en el cerebro (de la misma forma que la leptina es la hormona que nos da la señal de saciedad al comer), por esa razón, los roedores knockout no se sintieron saciados al copular y continuaron haciéndolo.
¿Y qué pasa en la amígdala y en el VTA?
Se observó que dicho comportamiento tenía cierta relación con el síndrome de Klüver-Bucy en humanos. Se trata de un síndrome que suele conllevar conductas hipersexuales, cambios emocionales (conductas temerarias) o agnosia visual, entre otras. Esto se debe a una lesión en la amígdala (véase la zona azul en la figura 1), por lo que Zakharian y colaboradores comprobaron si había cambios en las neuronas amigdalinas de los roedores. Se verificó que al añadir T en la amígdala de los machos, se pudo activar las neuronas de dicha zona, pero no las de aquellos roedores que carecían de TRPM8.
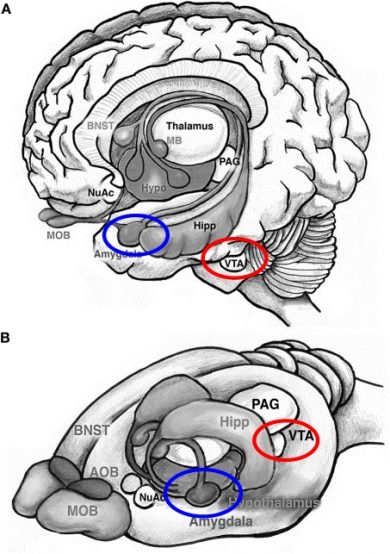
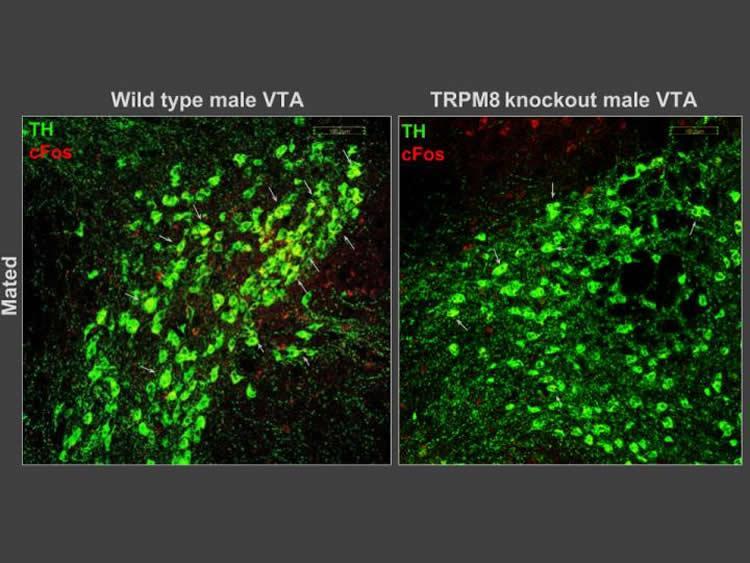
Por otra parte, otra zona cerebral interesante es el área tegmental ventral (VTA) (en rojo en la figura 1), ya que en esta zona es donde pasa la ruta dopaminérgica y, por ende, está relacionada con la recompensa sexual. Se observó que esta zona no se activó en los ratones knockout. Esto desembocó, por tanto en una mayor conducta sexual y agresiva en dichos animales.
Conclusiones y futuras posibles implicaciones en humanos
Los investigadores concluyeron que la molécula TRPM8 puede ser crucial a la hora de indicar la conducta inducida por la testosterona al activar la primera los centros de recompensa del cerebro.
En cuanto a las implicaciones en humanos, pues el tiempo dirá si esto también sucede de la misma forma; aún es demasiado pronto para saberlo. Esto supondría que podríamos dar con la tecla a la hora de hacer terapia sexual en pacientes adictos al sexo, o poder crear un fármaco para regular conductas impulsivas en personas agresivas, como por ejemplo, las personas que están en centros de menores o centros penitenciarios condenados por violación o agresiones físicas.
Pero, pese a que la biología de los roedores es muy similar a la nuestra (por eso se hacen estos estudios), es mejor pecar de prudentes, porque, recordemos, la influencia de las hormonas, neurotransmisores, etc., en nuestro cuerpo y su repercusión en nuestra conducta es muy compleja, además de ser multifactorial.
Este estudio nos da una pieza del puzle; ahora queda por ver cómo se ensamblan las demás para que el todo tenga coherencia y se arroje algo de luz. La ciencia es así: avanza pasito a pasito subida a hombros de gigantes (investigaciones previas), con la espada de Damocles de la refutación que pende sobre su cabeza.
Referencias bibliográficas
- Andreu, J. M., García-Bonacho, M., Esquifino, A., Ramirez, J. M. (2001). Moderating effect of aggressiveness, anger and hostility on concentrations of testosterone and cortisol in saliva. Aggressive Behavior, 27, 166-167.
- Archer, J. (2006). Testosterone and human aggression: An evaluation of the challenge hypothesis. Neuroscience and Biobehavioral Reviews, 30(3), 319-345.
- Biophysical Society (1 de marzo de 2019). Sex and Aggression Controlled by Cold Sensor in Brain: Mouse Study. NeuroscienceNews. Retrieved March 1, 2019 from http://neurosciencenews.com/cold-sensor-sex-aggression-10843/
- Conner, R.L. y Levine, S. (1969). Hormonal influences and aggresive behaviour. En Garattini (Ed.), Aggresive Behaviour. New York: Wiley.
- Gil-Verona, J. A., Pastor, J. F., De Paz, F., Barbosa, M., Macías, J. A., Maniega, M. A., … y Picornell, I. (2002). Psicobiología de las conductas agresivas. Anales de psicología, 18(2), 293-303.
- Mann J. (1994). Violence and aggression. En F.E. Bloom y D. Kupfer (Eds.), Psychopharmacology: The Fourth Generation of progress. New York: Raven Press.
- Nersesyan, Y., Gribkova, E., Baskaran, P., Llano, D., Thyagarajan, B. y Zakharian, E. (2019). TRPM8 Regulates Sexual Reward and Satiety. Biophysical Journal, 116 (3), 452a. DOI: https://doi.org/10.1016/j.bpj.2018.11.2441
- Sánchez-Martin, J.R. (2000). Testosterone level may be a marker of conflict behavior in male and female preschool children. Comunicación presentada al XIV world meeting of the International society for research on aggression. IS-5.1 Valencia, Julio.
- Zhang, L. y Barritt, G. J. (2004). Evidence that TRPM8 is an androgen-dependent Ca2+ channel required for the survival of prostate cancer cells. Cancer Res. 64 (22): 8365–73. doi:10.1158/0008-5472.CAN-04-2146. PMID 15548706.
- Imagen de portada: Jorge Lucas © 2019 (basado en A, B y C).
- Figura 1: Sokolowski y Corbin, 2012, Creative Commons (CC BY 4.0). Modificada por Jorge Lucas para los fines divulgativos de esta entrada.
- Figura 2: Biophysical Society (1 de marzo de 2019).

